原子の構造を理解することは、のちに解説するα線、β線、γ線の発生原理や様々な放射線と物質の間で発生する現象の理解に重要となります。
原子の構造
原子は原子核を中心にその周りを軌道電子がまわっている構造となっています(図1)。
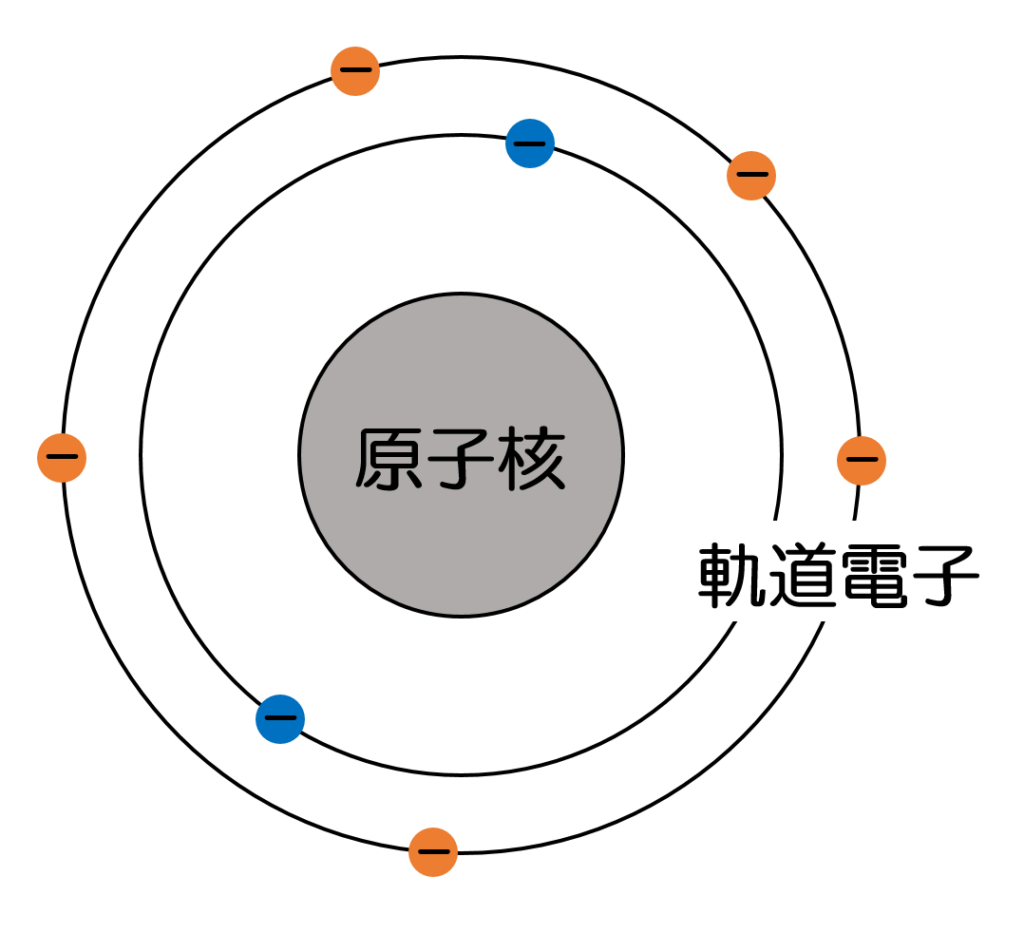
図1 原子の構造
原子核がプラス電荷、軌道電子がマイナスの電荷をもつため原子全体としては中性(プラスでもマイナスでもない)になります。
原子核の構造
原子核は陽子と中性子から構成されています(図2)。陽子はプラスの電荷、中性子は電荷をもたないため、原子核全体としてプラスの電荷をもつことになります。
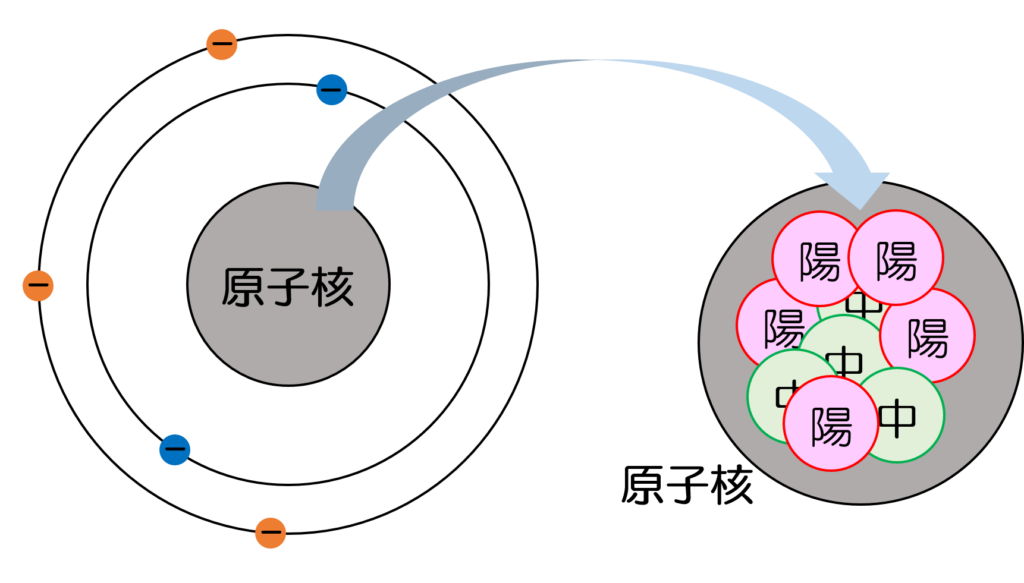
図2 原子核の構造
また、原子核構成する陽子と中性子を総称して核子と呼ばれます。
元素と核種の表し方
原子の場合、異なったタイプの原子を元素と呼びますが、原子核の場合は、原子核の異なるタイプを核種と呼びます。
核種は以下のように表します。
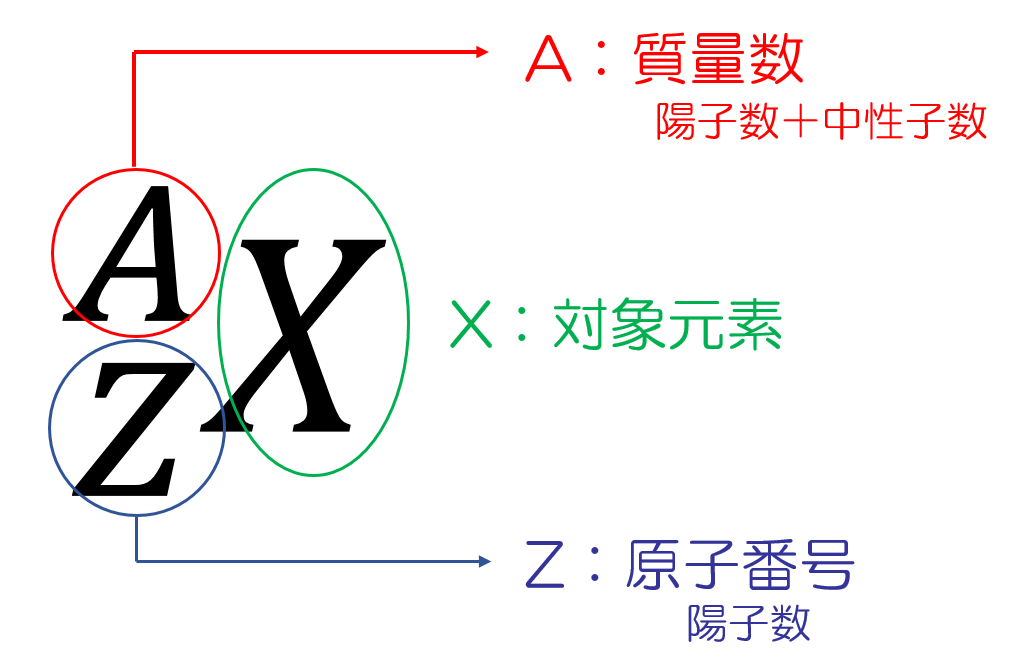
元素の種類は原子番号(原子核内の陽子の数)のみによって決定され、核種は原子番号と質量数(原子核内の陽子と中性子の数の合計)によって決定されます。
図3の例では、陽子が5個、中性子が5個のため質量数10、原子番号5のホウ素(B)であることが分かります。
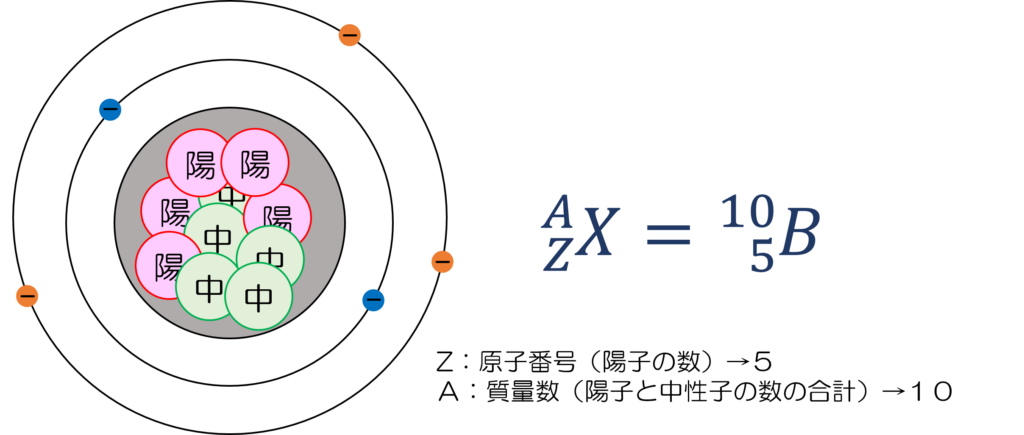
図3 元素の表し方
核種は質量数、中性子数、原子番号(陽子数)に応じて、以下のように分類されます。
- 同位体(isotope):同じ陽子数(図4)
- 同重体(isobar):同じ質量数(例:質量数131のヨウ素Iと質量数131のキセノンXe)
- 同中性子体(isotone):同じ中性子数(例:中性子数6個の窒素Nと酸素O)
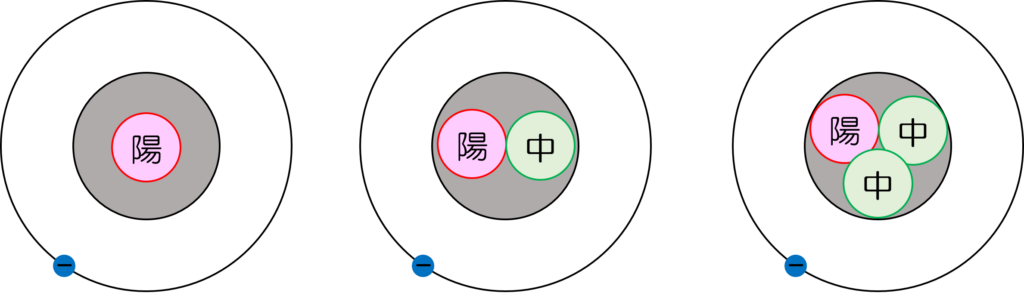
図4 同位体の例
水素(左)、二重水素(中央)、三重水素(右)を表している。
まとめ
- 原子は原子核を中心にその周りを軌道電子がまわっている構造です。
- 原子核はプラス、軌道電子はマイナスの電荷をもちます。
- 原子核構成する陽子と中性子を総称して核子と呼ぶことがあります。
- 核種は質量数、中性子数、原子番号(陽子数)に応じて、同位体、同重体、同中性子体に分類されます。
今回は原子と原子核の構造について解説しました。この単元はα線、β線、γ線の発生原理や様々な放射線と物質の間で発生する現象の理解に重要となりますので、しっかりと覚えてもらえればと思います。
次回以降で、α線、β線、γ線の発生について触れたいと思います。



